Le cause dell’infertilità femminile
Secondo l’Organizzazione Mondiale della Sanità (OMS), una coppia può definirsi infertile solo quando vi è un’assenza di concepimento dopo un anno di rapporti frequenti e non protetti.
Mentre la sterilità è quando uno o entrambi i coniugi di una coppia sono affetti da una condizione fisica permanente che non renda possibile il naturale concepimento.
Laddove non sia possibile un concepimento spontaneo si può optare per tecniche di fecondazione assistita che consistono nella fecondazione in vivo, quindi intracorporea o in vitro metodiche extracorporee.
Le cause dell’infertilità femminile sono di circa il 15/20% e tale infertilità è data anche da una ritardata epoca di concepimento.
Infatti, il picco massimo di fertilità si raggiunge intorno ai 25 anni di età della paziente, e questo picco subisce un lento declino del potenziale riproduttivo che si aggira intorno ai 30/35 anni di età della paziente.
Oltre all’età, le altre cause dell’infertilità femminile possono essere associate ai disturbi dell’ovulazione, endometriosi, fattore tubarico peritoneale, anomalie uterine o cervicali o alterazioni immunologiche e proprio come nell’infertilità maschile, anche in questo caso ci possono essere cause idiopatiche.
L’iter diagnostico è basato su indagini specifici che individuano la causa e tali indagini devono essere condotti in tempi brevi e rapidi per adempiere al più efficace trattamento per l’infertilità femminile.
Cause dell’infertilità: primaria e secondaria
Per quanto riguarda le cause di infertilità, possiamo distinguere quella primaria e quella secondaria.
L’infertilità primaria è quando una paziente non ha mai avuto un concepimento ed è superiore in età di donne comprese tra i 20 e i 24 anni; mentre l’infertilità di tipo secondaria si riferisce a quelle pazienti che hanno avuto dei pregressi aborti o gravidanze di tipo anembrionica e quest’ultima aumenta con l’età.
Tra le sindromi più comuni abbiamo la sindrome dell’ovaio policistico (POCs), la quale può essere considerata un disturbo endocrinologico che caratterizzata da una condizione anovularietà cronica che si traduce in oligo-amenorrea ed infertilità.
Nella maggior parte dei casi risultano alterati i meccanismi che vanno a regolare la follicologenesi e soprattutto la selezione del follicolo dominante e infine dell’ovulazione. L’esatto meccanismo che però spieghi questo fenomeno non è stato ancora ben stabilito.
Inoltre, nel 7% dei casi delle pazienti che soffrono dell’ovaio policistico si presenta anche una condizione di insulino resistenza.
La produzione in quantità eccessive di androgeni comporta una non normale follicologenesi la quale non permette la produzione di un follicolo maturo il quale non potrà essere fecondato e ciò comporta ad un incremento dell’atresia follicolare; il tutto ha un effetto negativo sulla componente ovocitaria.
La diagnosi è subordinata dal riscontro di almeno due dei tre criteri dove vi deve essere:
- un oligo o anovulazione cronica;
- segni clinici e biochimici di iperandrogenismo;
- segni ecografici come un volume ovarico che è maggiore di 0,10 cm3 e maggiore di 12 follicoli di dimensioni comprese fra due e 9 mm in almeno in un ovaio.
Ai fini del ripristino spontaneo della regolarità mestruale dell’ovulazione, l’approccio terapeutico si basa sul miglioramento dell’assetto metabolico mediante un cambiamento dello stile di vita, apportando cambiamenti a livello nutrizionistico ed eventualmente l’utilizzo di farmaci per l’insulino-sensibilizzanti e l’utilizzo di farmaci antiandrogeni.
Altre cause di infertilità femminile: ipotiroidismo, distiroidismi e iperprolattinemia
Un’altra causa che va a determinare l’infertilità di tipo femminile è l’ipotiroidismo, che si verifica con un alterata pulsatilità dell’ormone del rilascio delle gonadotropine (GnRH) il quale causa fenomeni di oligo-amenorrea.
Tale forma di infertilità viene chiamata distiroidismi.
Un’altra causa di distiroidismi è anche la relazione tra gli autoanticorpi tiroidei, la presenza di immunità tiroidea determinata all’incremento degli aborti; quindi, la riduzione del tasso di fecondazione dell’impianto anche in presenza di un buon compenso ormonale, tale effetto può essere annullato con la terapia.
Ancora, l’iperprolattinemia può essere una causa di infertilità, infatti tale ormone rappresenta un’interfaccia tra ambiente e potenziale riproduttivo.
Questo può essere alterato dalle condizioni di stress, carenza di cibo e aumenti e l’aumento della prolattina va a determinare una riduzione della fertilità. I livelli di prolattina sono legati anche alla fase del sonno e dell’esercizio fisico e dell’assunzione di pasti iperproteici, quando i livelli plasmatici di prolattina sono alti, possono causare amenorree l’iperprolattinemia va a interferire con la normale pulsatilità della creazione del GnRH, quindi altera le gonadotropine, altera l’LH nel picco pre-ovulatorio determinando il blocco dell’ovulazione.
Cause di tipo idiopatiche
Inoltre, nel 30% delle donne le cause di iperprolattinemia sono di tipo idiopatiche.
Numerosi farmaci, inoltre, possono stimolare la secrezione di prolattina, quali per esempio farmaci antinausea, anti vomito neurolettici psicotici o oppiacei e per escludere le forme di prolattinemia di tipo micro-adenoma o macro-adenoma, va effettuato un time course attraverso un prelievo con catetere eparinizzato in situ per permettere il dosaggio della prolattina effettuata a tempo zero, a 15 minuti e a 30 in quanto la prolattina può aumentare anche in caso di stress d’ago per poi ritornare in a livelli normali.
Mentre per escludere il micro-adenoma o il macro-adenoma vengono effettuate indagini strumentali come la risonanza magnetica.
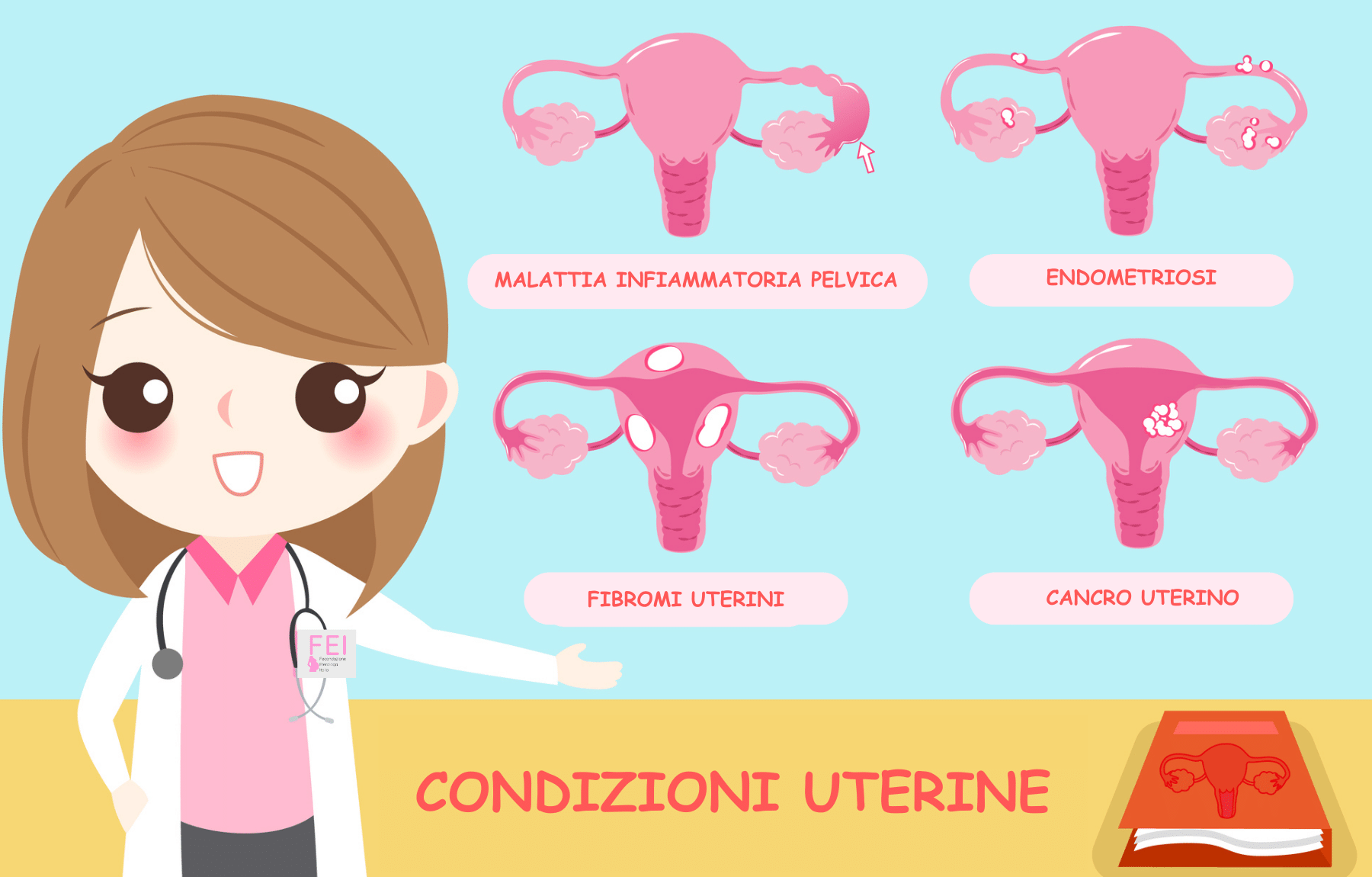
L’endometriosi
Un’altra causa che va a determinare l’infertilità è l’endometriosi. Questa è una malattia cronica, infiammatoria e di tipo estrogeno dipendente, dove si va a sviluppare del tessuto endometriale al di fuori della cavità uterina, come, per esempio, nelle Tube di Falloppio, il quale si manifesta con dolore pelvico, infertilità o masse annessiali.
I principali fattori di rischio sono per esempio l’indice di massa corporea, l’uso di alcool e fumo, questa può essere una patologia multifattoriale, dove vi può essere anche una mestruazione di tipo retrogada.
L’endometriosi ha effetti negativi sulla funzione ovarica tubarica, sulla ricettività degli spermatozoi, in quanto le donne affette da endometriosi hanno delle concentrazioni di interleuchine come: IL-6, IL-1, IL-10 e il fattore di necrosi tumorale (TNF).
Ciò incide su disfunzioni ovulatorie, vi è una scarsa quantità di ovociti e di conseguenza le percentuali di fecondazione calano.
A livello tubarico, infatti, le pazienti affette da endometriosi l’interazione tra lo spermatozoo e l’epitelio sembra essere alterato. La laparoscopia è il principale oggetto di indagine per la diagnosi dove si vanno a definire quattro stadi della patologia anche se tale classificazione ha uno scarso valore in termini di fertilità.
I fibromi e l’infertilità femminile
La presenza di fibromi, ossia tumori, nella parte uterina, può essere associata ad infertilità per alterata contrattilità uterina e polpi hanno un’incidenza del 24% e sono diagnosticati tramite immagini
ultrasonografiche.
La formazione di polpi interferisce con il potenziale riproduttivo poiché rappresenta un ostacolo nella risalita degli spermatozoi interferendo con la ricettività endometriale.
Per l’iter diagnostico dell’infertilità femminile si fa un’anamnesi familiare o materna, in particolare la presenza di malattie cromosomici, eventi tromboembolici, l’età, abitudini sessuali.
Si effettua una visita ginecologica dove sarà fatto un esame ecografico dove verrà eseguita la morfologia ovarica per escludere anche la sindrome dell’ovaio policistico, la presenza di cisti ovariche, l’aspetto e la morfologia uterina, quindi la presenza di miomi, malformazioni, esclusioni di infezioni nel tratto genitale, viene effettuata anche una conta di follicoli antrali.
Il numero dei follicoli viene fatto entro il quinto giorno del ciclo e viene integrata con il dosaggio dell’ormone antimulleriano (AMH) per stabilire la riserva ovarica al fine di scegliere la dose ottimale della somministrazione delle gonadotropine.
In caso di fecondazione assistita, lo studio ecografico va a determinare inoltre il ciclo ovulatorio sia con finalità diagnostiche che terapeutiche.
Le indagini di laboratorio
Altre indagini che possono essere effettuate in laboratorio possono essere il dosaggio dell’LH dell’estradiolo del progesterone e quota androgenica, globuline leganti steroidi sessuali, il profilo tiroideo e la prolattina, che devono essere effettuati entro il secondo terzo giorno del ciclo.
Il dosaggio della glicemia e dell’insulina, anemia ed eventuale test orale di tolleranza al glucosio. Inoltre, e deve essere escluso la presenza di infezioni quali Chlamydia tracomatis, Mycoplasma hominis, Ureaplasma urealyticum; infine, la presenza di miomi, polipi, endometriali o malformazioni mediante isteroscopia va valutato anche uno stato autoimmunitario. In particolare, si andrà a valutare anche accidenti tromboembolici in età giovanile e la mutazione di Trombofiliche per le MTHFR A1298C, MTHFR C677T.










Non ci sono commenti